时间:2024-04-10 浏览次数:1354
缺氧所带来的肿瘤细胞代谢变化主要是由HIF-1通路介导,这会使肿瘤细胞在缺氧环境下增加糖酵解途径而非三羧酸循环获得能量,同时产生的乳酸被单羧酸转运体排出细胞外,酸性环境进一步促进肿瘤生长、血管生成、免疫逃避和治疗抵抗。
能量代谢、增殖和细胞迁移 /
慢性缺氧研究
近几年来,肺癌占癌症相关死亡人数的25%,其中超过80%的诊断病例为非小细胞肺癌,针对慢性缺氧对非小细胞肺癌能量代谢、细胞增殖和细胞周期期分布的影响及其相互关系中,在文献《Hypoxia Changes Energy Metabolism and Growth Rate in Non-Small Cell Lung Cancer Cells》有提到相关研究,它选取P53 wt (A549)和P53 null (H358)非小细胞肺癌细胞系进行长期的中度缺氧和重度缺氧实验,如下。

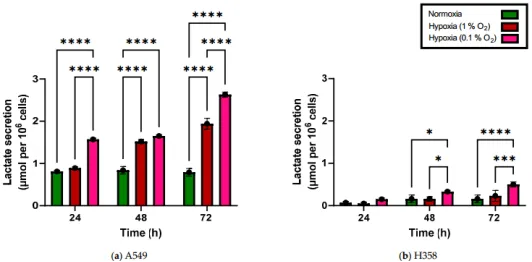
可以看出A549细胞系在不同氧浓度下的葡萄糖消耗和乳酸代谢方面差异显著,而在缺少P53的H358细胞系中虽然有类似趋势但是并没有像A549那么显著,过量的葡萄糖摄取也并不伴随着氧化磷酸化的相应增加,而是乳酸产量的增加。
从下图可以看出两种细胞系在常氧条件下细胞周期期分布差异不显著,但缺氧A549细胞G1群明显高于缺氧H358细胞,G2群明显低于缺氧H358细胞。
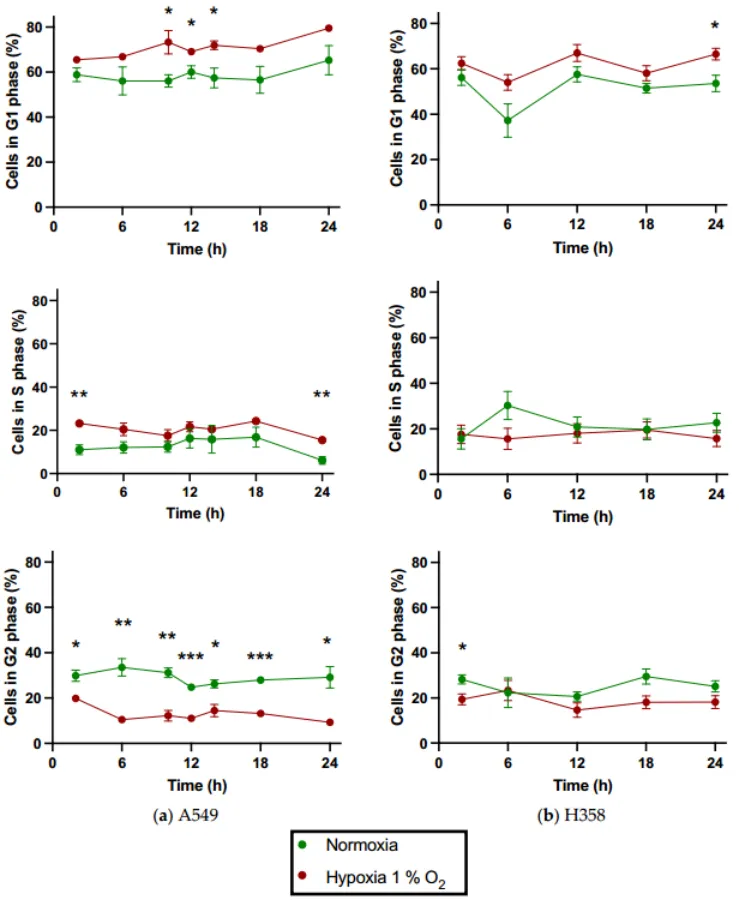
此外,A549细胞在1%O2的持续缺氧下似乎也表现出S期阻滞。这些发现可以再一次基于两种细胞系之间P53状态的差异来解释。在缺氧条件下,功能性TP53基因转化为P53蛋白,其上调导致P21蛋白水平升高,这可能导致细胞周期停滞在G1期。
同样,缺氧也可以通过下调周期蛋白A导致S期细胞周期阻滞,而周期蛋白A是P21的已知靶点,相比之下,缺氧诱导的H358细胞周期阻滞必须通过P53独立机制发生,主要发生在G2/M检查点,与A549细胞相比,导致细胞周期改变不那么明显。
无论P53状态如何,长时间缺氧都会导致非小细胞肺癌细胞系细胞能量代谢、增殖和细胞迁移的变化。在0.1%和1%O2条件下,NSCLC细胞系均表现出能量代谢的适应性即糖酵解的增加和乳酸分泌的增加。在缺氧条件下,这两种细胞系的增殖率都有所下降。
避免短时激活效应 /
如何创造稳定的培养内环境
然而,在细胞能量学的背景下,对缺氧代谢反应的差异并没有转化为两种细胞系在缺氧下加倍时间延长的程度上。细胞增殖的下降似乎是由于细胞在G1期和远离细胞周期G2期的重新分布所致,这可能和P53调控细胞周期的能力有关。
有相关研究表明P53基因在4小时的低氧环境下短暂激活,这可能解释为什么在研究中A549在缺氧条件下的较高葡萄糖消耗,很显然几十小时后的基因组学研究相对这种瞬时激活带来的影响而言长了些。
但是由于开关门的氧气波动,三气培养箱中没有办法稳定维持较低的氧气浓度,这种短时激活对细胞带来的重大影响改变只能在稳定的环境下进行实验,为此我们推出了全新的IPAN低氧工作站,能全面模拟肿瘤细胞的自然缺氧体内环境。
环境避光原生态/
IPAN
配备专业的旋风旋转闸彻底清除外界空气干扰,避免内腔环境扰动,使细胞稳定处于生理氧环境下,减少氧波动带来的影响;

IPAN低氧工作站,为细胞研究提供全面的原生态环境模拟,能有效提升实验的准确性,防止各种氧波动对细胞的影响,为微生物科研持续助力。

Copyright 2024 IPANNATURE 版权所有 备案号:沪ICP备20012062号-4
管理登录 技术支持:化工仪器网 sitemap.xml